"A VANTAGEM DE SER INTELIGENTE É QUE PODEMOS FINGIR QUE SOMOS IMBECIS, ENQUANTO O CONTRÁRIO É COMPLETAMENTE IMPOSSÍVEL"
domingo, 31 de março de 2013
O INCRÍVEL CASO DAS FORMIGAS-ZUMBI
O INCRÍVEL CASO DAS FORMIGAS-ZUMBI
As formigas são caracterizadas, principalmente, pela sua organização em sociedade, ou seja, cada indivíduo apresenta um grau de cooperação no grupo, comunicação e divisão do trabalho. No entanto, essa propriedade é “posta em xeque” quando o organismo é parasitado por um fungo capaz de alterar radicalmente o seu comportamento, transformando-o em formigas zumbis.
Os esporos do fungo responsável por esse estado, cujo nome científico é Ophiocordyceps unilateralis, invadem o organismo das formigas da espécie Camponotus leonardi por meio de poros distribuídos pelo corpo das mesmas, dando início a todo o processo. Tal espécie de formigas vive, em geral, nas copas de árvores, no entanto, podem passar pelo chão e, dessa forma, serem infectadas pelo fungo.
Uma vez no organismo da formiga, o fungo passa a dominar completamente o comportamento das formigas (por mecanismos ainda desconhecidos): o andar fica desordenado, em círculos, em ziguezague, parecido mesmo com um zumbi, daí a expressão formigas zumbis. O sistema nervoso central e as fibras musculares da formiga são os alvos do parasita, pois somente dessa forma conseguem controla-las. Assim, é possível fazer com que tais insetos migrem para um local úmido e frio, ambiente ideal para o desenvolvimento e reprodução do fungo.
Quando no local determinado pelo fungo, a formiga contaminada tem sua mandíbula manipulada pelo parasita e é induzida a morder uma folha de plantas rasteiras, geralmente na parte inferior. Depois disso, a hospedeira morre e o fungo passa a se alimentar do seu corpo, utilizando, sobretudo, os carboidratos que compõem seu exoesqueleto. Em algumas pesquisas a respeito das formigas zumbis, foi verificado que, durante o período em que os fungos se nutrem delas, a parte externa do corpo desta fica ilesa, de maneira que outros microrganismos não percebam que há ali uma fonte de alimento. Foi visto, ainda, que a mandíbula da formiga também permanece ilesa, para que o corpo se mantenha fixo à folha.
A combinação do ambiente perfeito com uma fonte de nutrição torna o fungo totalmente capaz de crescer e se reproduzir. Agora desenvolvidos, os fungos rompem a cabeça da formiga, se libertam da carcaça e migram novamente em busca de novos hospedeiros, dando continuidade ao ciclo.
Existem alguns estudos a respeito das formigas zumbis, mas muito se tem a esclarecer sobre esse processo, como, por exemplo, a forma com que o fungo controla o comportamento das hospedeiras; de que maneira e em até que ponto as formigas são susceptíveis a esse parasitismo; o motivo pelo qual os fungos escolhem as formigas; se existem estratégias de defesa das formigas contra o ataque dos fungos, além da expulsão daquelas infectadas; o que determina exatamente o abandono do corpo das hospedeiras pelos parasitas; como age a outra espécie de fungos (Tremella fuciformis) que ataca os causadores das formigas zumbis, entre outros questionamentos.
Referências
http://misteriosdomundo.com/o-incrivel-caso-das-formigas-zumbi
http://veja.abril.com.br/noticia/ciencia/fungos-que-transformam-formigas-em-zumbis-estao-sob-ataque-de-outro-fungo
http://g1.globo.com/natureza/noticia/2011/03/pesquisa-descobre-fungos-que-geram-formigas-zumbis-em-mg.html
Foto: http://curiosity101.com/curious-things-about-zombie-ants/
http://misteriosdomundo.com/o-incrivel-caso-das-formigas-zumbi
http://veja.abril.com.br/noticia/ciencia/fungos-que-transformam-formigas-em-zumbis-estao-sob-ataque-de-outro-fungo
http://g1.globo.com/natureza/noticia/2011/03/pesquisa-descobre-fungos-que-geram-formigas-zumbis-em-mg.html
Foto: http://curiosity101.com/curious-things-about-zombie-ants/
O parasitismo não é um fenômeno muito raro. Em geral, ocorre quando um dos organismos, chamado de parasita, vive à custa de outro organismo, chamado hospedeiro. Parasitas que vivem na superfície ou exterior do hospedeiro são chamados ectoparasitas; aqueles que vivem no interior, endoparasitas. O parasitismo pode variar em grau, isto é, há desde formas quase inócuas até as que causam a morte do hospedeiro.
Diferentemente do mutualismo, onde ambos os organismos são beneficiados, o parasitismo sempre é um jogo desbalanceado.
O fungo Ophiocordyceps unilateralis, tal como um fungo, vive como um fungo e apresenta a forma de um fungo, mas apresenta estratégias realmente muito “estranhas”: ele transforma formigas em zumbis! Isso mesmo. O fungo em questão não só é um parasita, como também manipula seu hospedeiro.
Quando os esporos do fungo, de alguma forma, entram no organismo de uma formiga, atacam em volta das fibras musculares e do cérebro da hospedeira, fazendo-a andar desordenadamente, em círculos ou até mesmo ter convulsões. Após algum tempo cambaleando, a formiga morde uma folha e fica presa ali, até morrer. Depois de alguns dias, como nos filmes de ficção científica, a cabeça da formiga é rompida, dando origem a uma massa de filamentos conhecida como micélio, ou hifas.
Durante todo o processo, as hifas alimentam-se do cérebro da formiga, que agora já está morta. Para aumentar a capacidade de disseminação de esporos, os fungos ainda produzem esporóforos – estruturas que elevam-se sobre o plano do micélio, onde são produzidos os esporos. Depois que o “broto” está plenamente formado, novos esporos são liberados no ambiente, reiniciando o ciclo de parasitismo.
O parasita do parasita
Para completar o ciclo de oportunismo, ainda existe um fungo que ataca o fungo que transforma as formigas em zumbis. “A biologia é mais estranha do que a ficção, o parasita do causador das formigas-zumbis é também um fungo”, diz David Hughes, da Universidade da Pensilvânia e condutor do estudo.
O parasita secundário, ao entrar em contato com o hospedeiro infectado pelo Ophiocordyceps unilateralis, impede que o fungo que transforma as formigas se reproduza, pois passam a limitar a produção de esporos e as hifas. “Os parasitas efetivamente castram os fungos responsáveis pela transformação de formigas em zumbis”, diz Hughes. Mas, isso não significa que a formiga infectada se salvará. A pesquisa também relata o aspecto dinâmico que ocorre entre as três espécies.
Vale lembrar que isso tudo ocorre aqui no Brasil e alguns outros lugares do mundo. [PLos One, Nature]
segunda-feira, 25 de março de 2013
O SIGNIFICADO DA PÁSCOA...
O significado da Páscoa...
A Páscoa é uma festa cristã que celebra a ressurreição de Jesus Cristo. Depois de morrer na cruz, seu corpo foi colocado em um sepulcro, onde ali permaneceu, até sua ressurreição, quando seu espírito e seu corpo foram reunificados. É o dia santo mais importante da religião cristã, quando as pessoas vão às igrejas e participam de cerimônias religiosas.Muitos costumes ligados ao período pascal originam-se dos festivais pagãos da primavera. Outros vêm da celebração do Pessach, ou Passover, a Páscoa judaica. É uma das mais importantes festas do calendário judaico, que é celebrada por 8 dias e comemora o êxodo dos israelitas do Egito durante o reinado do faraó Ramsés II, da escravidão para a liberdade. Um ritual de passagem, assim como a "passagem" de Cristo, da morte para a vida.
No português, como em muitas outras línguas, a palavra Páscoa origina-se do hebraico Pessach. Os espanhóis chamam a festa de Pascua, os italianos de Pasqua e os franceses de Pâques.
Nossos amigos de Kidlink nos contaram como se escreve "Feliz Páscoa" em diferentes idiomas. Assim:

A festa tradicional associa a imagem do coelho, um símbolo de fertilidade, e ovos pintados com cores brilhantes, representando a luz solar, dados como presentes. A origem do símbolo do coelho vem do fato de que os coelhos são notáveis por sua capacidade de reprodução. Como a Páscoa é ressurreição, é renascimento, nada melhor do que coelhos, para simbolizar a fertilidade!
Quem sabe o que é "Theobroma"? Pois este é o nome dado pelos gregos ao "alimento dos deuses", o chocolate. "Theobroma cacao" é o nome científico dessa gostosura chamada chocolate. Quem o batizou assim foi o botânico sueco Linneu, em 1753.
Mas foi com os Maias e os Astecas que essa história toda começou.
O chocolate era considerado sagrado por essas duas civilizações, tal qual o ouro.
Na Europa chegou por volta do século XVI, tornando rapidamente popular aquela mistura de sementes de cacau torradas e trituradas, depois juntada com água, mel e farinha. Vale lembrar que o chocolate foi consumido, em grande parte de sua história, apenas como uma bebida.
Em meados do século XVI, acreditava-se que, além de possuir poderes afrodisíacos, o chocolate dava poder e vigor aos que o bebiam. Por isso, era reservado apenas aos governantes e soldados.
Aliás, além de afrodisíaco, o chocolate já foi considerado um pecado, remédio, ora sagrado, ora alimento profano. Os astecas chegaram a usá-lo como moeda, tal o valor que o alimento possuía.
Chega o século XX, e os bombons e os ovos de Páscoa são criados, como mais uma forma de estabelecer de vez o consumo do chocolate no mundo inteiro. É tradicionalmente um presente recheado de significados. E não é só gostoso, como altamente nutritivo, um rico complemento e repositor de energia. Não é aconselhável, porém, consumí-lo isoladamente. Mas é um rico complemento e repositor de energia.
A tradição do coelho da Páscoa foi trazida à América por imigrantes alemães em meados de 1700. O coelhinho visitava as crianças, escondendo os ovos coloridos que elas teriam de encontrar na manhã de Páscoa.
Uma outra lenda conta que uma mulher pobre coloriu alguns ovos e os escondeu em um ninho para dá-los a seus filhos como presente de Páscoa. Quando as crianças descobriram o ninho, um grande coelho passou correndo. Espalhou-se então a história de que o coelho é que trouxe os ovos. A mais pura verdade, alguém duvida?
No antigo Egito, o coelho simbolizava o nascimento e a nova vida. Alguns povos da Antigüidade o consideravam o símbolo da Lua. É possível que ele se tenha tornado símbolo pascal devido ao fato de a Lua determinar a data da Páscoa.
Mas o certo mesmo é que a origem da imagem do coelho na Páscoa está na fertililidade que os coelhos possuem. Geram grandes ninhadas!
O dia da Páscoa é o primeiro domingo depois da Lua Cheia que ocorre no dia ou depois de 21 março (a data do equinócio). Entretanto, a data da Lua Cheia não é a real, mas a definida nas Tabelas Eclesiásticas. (A igreja, para obter consistência na data da Páscoa decidiu, no Conselho de Nicea em 325 d.C, definir a Páscoa relacionada a uma Lua imaginária - conhecida como a "lua eclesiástica").
A Quarta-Feira de Cinzas ocorre 46 dias antes da Páscoa, e portanto a Terça-Feira de Carnaval ocorre 47 dias antes da Páscoa. Esse é o período da quaresma, que começa na quarta-feira de cinzas.
Com esta definição, a data da Páscoa pode ser determinada sem grande conhecimento astronômico. Mas a seqüência de datas varia de ano para ano, sendo no mínimo em 22 de março e no máximo em 24 de abril, transformando a Páscoa numa festa "móvel".
De fato, a seqüência exata de datas da Páscoa repete-se aproximadamente em 5.700.000 anos no nosso calendário Gregoriano.
Para os curiosos, olha aí as datas da Páscoa até o ano de 2010:
- 2000 - 23 de abril
- 2001 - 15 de abril
- 2002 - 31 de março
- 2003 - 20 de abril
- 2004 - 11 de abril
- 2005 - 27 de março
- 2006 - 16 de abril
- 2007 - 08 de abril
- 2008 - 23 de março
- 2009 - 12 de abril
- 2010 - 04 de abril
Vamos conhecer agora
os outros símbolos da Páscoa!
os outros símbolos da Páscoa!
domingo, 24 de março de 2013
MATERIA - ATIVIDADES
QUÍMICA - Matéria
Matéria: tudo o que possui massa e ocupa lugar no espaço.
Corpo: toda porção limitada de matéria.
Extensão: espaço ocupado pela matéria. Sua medida é o volume.
Substância: espécie de matéria que se distingue por suas qualidades.
2. Os estados físicos da matéria
Características dos estados:
• sólido: forma e volume constantes (partículas bem próximas umas das outras).
• líquido: volume constante e forma variável (partículas mais afastadas umas das outras).
•gasoso: forma e volume variáveis (as partículas ficam bem afastadas umas das outras).
Mudanças de estado físico:
a) Fatores determinantes: pressão e temperatura
b) Processos:
• Fusão: passagem de sólido para líquido, com aumento de temperatura ou diminuição de pressão. Ocorre a uma determinada temperatura (ponto de fusão), que permanece constante durante o processo. Com o aumento da pressão, o ponto de fusão fica mais alto.
• Solidificação: passagem de líquido para sólido, com aumento de pressão ou diminuição de temperatura. Ocorre a uma determinada temperatura (ponto de solidificação), que permanece constante.
• Vaporização: passagem de líquido para gasoso, com aumento de temperatura ou diminuição de pressão.
Tipos:
— evaporação (processo lento na temperatura ambiente);
— ebulição (processo rápido, com formação de bolhas gasosas na massa líquida);
— calefação (líquido em presença de superfície superaquecida).
•Condensação (ou liquefação): passagem de gasoso para líquido, com aumento de pressão ou diminuição de temperatura. Ocorre a uma determinada temperatura (ponto de condensação), que permanece constante.
• Sublimação: passagem de sólido diretamente para gasoso e vice-versa. Lembre que:
• Ponto de ebulição é a temperatura em que ocorre a ebulição (ela é constante durante o processo). O ponto de ebulição aumenta com o aumento da pressão.
A evaporação da água é tanto mais rápida quanto maior a superfície, maior a ação dos ventos e menor a umidade relativa do ar.
• A substância que nas condições naturais mantém-se no estado gasoso é chamada gás; chama-se vapor quando nas condições naturais é líquida ou sólida, mas em condições especiais pode passar para o estado gasoso.
• O ponto de ebulição da água, nas condições normais de pressão (ao nível do mar), é 100 Cº.
• O ponto de fusão do gelo, nas condições normais de pressão, é O °C. 1A matéria
Fenômeno: qualquer transformação que ocorre na natureza. Para estudá-lo, experimenta-se, faz-se observações, interpretam-se os resultados e tiram-se conclusões.
Físico: não altera a estrutura da matéria.
Químico: altera a estrutura da matéria.
Propriedades da matéria
Gerais: referem-se a toda e qualquer espécie de matéria.
Específicas: caracterizam cada substância,
1. Propriedades gerais:
a) Extensão: a matéria ocupa lugar no espaço. Sua medida é o volume, e suas unidades de medidas são o metro cúbico (m3), o centímetro cúbico (cm3), etc.
b) Massa: quantidade de matéria contida nos corpos. Pode ser medida em balanças. Suas unidades de medida são o quilograma (kg), o grama (g), etc.
c) Inércia: propriedade pela qual a matéria só modifica seu estado de repouso ou de movimento quando sob a ação de forças. Sua medida é a massa.
d) Impenetrabilidade: duas porções de matéria não podem ocupar, ao mesmo tempo, ao mesmo lugar no espaço.
e) Divisibilidade: a matéria pode ser subdividida até certo limite, conservando as propriedades das substâncias.
f) Indestrutibilidade: a matéria não é criada nem destruída, mas pode ser transformada.
g) Compressibilidade: a matéria pode ser reduzida em seu volume por ação de pressão.
h) Elasticidade: a matéria comprimida volta às condições primitivas quando cessa a pressão atuante sobre ela.
2. Propriedades específicas:
Físicas:
a) Calor específico: quantidade de calor necessária para elevar de 1°C a temperatura de 1 g da substância.
b) Densidade: relação entre massa e volume de uma substância: d=m/v
c) Solubilidade: propriedade pela qual uma substância (soluto) se dissolve na massa de outra (solvente).
d) Dureza: resistência que as substâncias oferecem ao risco.
e) Maleabilidade: capacidade de uma substância ser transformada em lâmina (chumbo, ouro).
f) Ductibilidade: propriedade de uma substância ser transformada em fios.
• Químicas: transformações que as substâncias sofrem na sua estrutura durante as combustões, oxidações, etc.
•Organolépticas: aquelas que impressionam nossos órgãos dos sentidos, como a cor, o odor, o sabor, etc.
ATIVIDADES
1-Defina e exemplifique:
a) matéria
b)corpo
c)fenômeno
d)fenômeno físico
e)fenômeno químico
f)substâncias
g)objeto
a) matéria
b)corpo
c)fenômeno
d)fenômeno físico
e)fenômeno químico
f)substâncias
g)objeto
2-O atrito de dois corpos produzindo calor é fenômeno físico ou químico? Por quê?
3-A produção do vinho a partir do suco de uva é um fenômeno físico ou químico? Por quê?
4-Como se denomina o espaço ocupado pela matéria? E sua medida?
5-complete o quadro:
Estados físicos Forma Volume
Sólido
Liquido
Gasoso
6- Qual o fator determinante dos três estados físicos da matéria?
7- A matéria pode mudar de um estado físico para outro. Quais os fatores responsáveis por isso?
8- Por que em planalto a água ferve a uma temperatura mais baixa do que a beira-mar?
9-Qual a diferença entre gás e vapor?
10- Esquematize as mudanças de estados físicos da matéria:
3-A produção do vinho a partir do suco de uva é um fenômeno físico ou químico? Por quê?
4-Como se denomina o espaço ocupado pela matéria? E sua medida?
5-complete o quadro:
Estados físicos Forma Volume
Sólido
Liquido
Gasoso
6- Qual o fator determinante dos três estados físicos da matéria?
7- A matéria pode mudar de um estado físico para outro. Quais os fatores responsáveis por isso?
8- Por que em planalto a água ferve a uma temperatura mais baixa do que a beira-mar?
9-Qual a diferença entre gás e vapor?
10- Esquematize as mudanças de estados físicos da matéria:
11-Relacione as colunas:
(a)compressibilidade ( )a matéria ocupa lugar nos espaço.
(b)massa ( )duas porções de matéria não podem, ao mesmo tempo,
(c)impenetrabilidade ( )ocupar o mesmo lugar no espaço. .
(d)inércia ( )quantidade de matéria de um corpo.
(e) extensão ( )a matéria só modifica seu estado de repouso ou de
( )Movimento quando sob ação de forças.
( )sob a ação de forças a matéria reduz o volume.
(a)compressibilidade ( )a matéria ocupa lugar nos espaço.
(b)massa ( )duas porções de matéria não podem, ao mesmo tempo,
(c)impenetrabilidade ( )ocupar o mesmo lugar no espaço. .
(d)inércia ( )quantidade de matéria de um corpo.
(e) extensão ( )a matéria só modifica seu estado de repouso ou de
( )Movimento quando sob ação de forças.
( )sob a ação de forças a matéria reduz o volume.
12- O que são propriedades especifica da matéria? Como podem ser?
13- Um fragmento de gelo de 250 g tem volume correspondente a 500 cm3. qual é sua densidade?
14- A densidade de um fragmento de chumbo é 11,4 g/cm3. sabendo-se que esse fragmento de metal ocupa um volume de 57 cm3, qual é sua massa?
13- Um fragmento de gelo de 250 g tem volume correspondente a 500 cm3. qual é sua densidade?
14- A densidade de um fragmento de chumbo é 11,4 g/cm3. sabendo-se que esse fragmento de metal ocupa um volume de 57 cm3, qual é sua massa?
15-Um corpo de massa igual a 200 g e tem um volume de 400 cm3. Responda:
a)Qual a densidade desse corpo? ___________________
b)Colocando num recipiente com água esse corpo afunda ou flutua? ___________________
16-Indique nas reações abaixo as transformações físicas e químicas:
a)queima do gasolina nos motores dos carros ___________________
b)digestão dos alimentos ingeridos ________________
c)acender uma lâmpada ___________________
d)formação da ferrugem ___________________
e)quebra de um objeto ___________________
f)enfiar um prego na madeira ___________________
g)derretimento de um iceberg ___________________
h)crescimento de uma planta ___________________
16-Indique nas reações abaixo as transformações físicas e químicas:
a)queima do gasolina nos motores dos carros ___________________
b)digestão dos alimentos ingeridos ________________
c)acender uma lâmpada ___________________
d)formação da ferrugem ___________________
e)quebra de um objeto ___________________
f)enfiar um prego na madeira ___________________
g)derretimento de um iceberg ___________________
h)crescimento de uma planta ___________________
Postado por CIÊNCIA E CONSCIÊNCIA às 06:28
SAIBA MAIS
SAIBA MAIS
Por que o oxigênio não acaba?
Você sabe que durante a respiração os animais e as plantas consomem oxigênio e eliminam gás carbônico.
Se existem seres vivos respirando dia e noite há milhões de anos, como se explica que oxigênio não acaba e não aumenta a quantidade de gás carbônico no ar?
A resposta é a seguinte: durante o dia, os vegetais verdes e as algas microscópicas realizam fotossíntese. Nesse processo, eles absorvem gás carbônico e liberam oxigênio, que vai substituindo aquele que os seres vivos gastam para respirar.
Assim, são as plantas e as algas que garantem a reposição do oxigênio, bem como a retirada do excesso de gás carbônico da atmosfera.
O ar precisa ser renovado
Quando muitas pessoas respiram juntas num recinto fechado, a quantidade de oxigênio no ar diminui, enquanto a de gás carbônico aumenta, tornando o ar impróprio para a saúde. Esse ar é chamado de “viciado” e está presente em lugares que não dispõem de sistemas eficientes de ventilação, como acontece em alguns cinemas, restaurantes, salas de aula, ônibus, etc. Além disso, o ar de recintos sem ventilação contamina-se com facilidade quando estão presentes uma ou mais pessoas portadoras de doenças transmissíveis pelo ar.
A ventilação de ambientes fechados pode ser feita com ventiladores e aparelhos de ar condicionado. Estes, além de possibilitar uma temperatura mais agradável, têm a vantagem de filtrar o ar, livrando-se de impurezas.
Também em casa é necessário tomar certos cuidados para a renovação do ar. Sempre que possível, é conveniente deixar as janelas abertas, para se renovar o ar do interior de nossas casas.
PLASMA
Há um quarto estado da matéria, chamado plasma, que raramente é visto. Existe somente em temperaturas muito altas no interior do Sol e de outras estrelas ou, na Terra, sob baixa pressão. Consiste de átomos divididos por grande calor ou eletricidade. A bola da figura abaixo, contém um eletrodo central rodeado de plasma. Se você toca a superfície, faíscas pulam na sua mão a partir do centro. As faíscas traçam caminhos ascendentes no plasma criados pelos átomos divididos.

Observações macroscópica e microscópica do plasma
MATÉRIA E SEUS ESTADOS FÍSICOS
MATÉRIA E SEUS ESTADOS FÍSICOS
Imagine uma montanha, um lago e o ar ao redor deles. Estão representados, aí, os três estados em que a matéria ocorre. Montanhas são feitas de rocha, que é sólida. Um lago é feito de água, que é líquida. E o ar que respiramos é feito de gás.

Três estados. Esta foto de uma fonte quente em Waiotapu, na Nova Zelândia, mostra os três estados da matéria, todos em um só lugar. A rocha é um sólido, a água é líquida e o vapor que sobe é um gás.
Os sólidos têm forma e volume definidos, mas em alguns, como a borracha, a forma pode ser alterada. Muitos sólidos são duros. Os líquidos têm volume fixo mas a forma é variável, e pode fluir. Porque podem fluir, os líquidos e gases são chamados fluidos. A maioria dos gases não pode ser vista.
Os três estados da matéria comportam-se cada qual à sua maneira porque as partículas que os compõem comportam-se de modo diferente.
(FIGURA 1A) a água é encontrada na natureza em três estados físicos: sólido, líquido e gasoso.
SÓLIDO
Um livro é um sólido: tem forma definida, que não é fácil de mudar. É que as partículas de um sólido são unidas umas às outra por ligações fortes em uma estrutura firme.

Observações macroscópica e microscópica de um livro.
SAIBA MAIS
As pedras respiram
Durante as pesquisas para a restauração do Teatro Municipal de São Paulo realizadas nos últimos anos, descobriu-se que, de certa forma, as pedras respiram.
Construído em 1911 pelo arquiteto Ramos de Azevedo, o prédio encontrava-se muito castigo pelo tempo. Boa parte das pedras com que ele foi construído é de arenito, uma rocha muito pouco compacta, porosa. Num processo natural, essas pedras trocam umidade com o ar, absorvendo maior ou menor quantidade de água. Como o arenito poroso absorve muita água, ele se desagrega com facilidade. Algumas placas de arenito do Teatro Municipal, por exemplo, estavam seguras apenas por arames, tal o nível de desagregação em que se encontravam.
A descoberta da jazida original dessas rochas permitiu substituir uma parte das placas. Mas em alguns casos os especialistas tiveram de usar um método pitoresco: vestiram as pedras com verniz impermeável, que repele a água mas não impede a troca de ar pela pedra.
Outras rochas do Municipal não apresentaram problemas respiratórios, como é o caso do mármore, mas tinham sido atacadas por uma substância da poluição paulistana, o ácido sulfúrico, proveniente da chuva ácida. Para proteger essas pedras da poluição, os técnicos aplicaram nelas um produto à base de acrílico.
O interessante é que essas pedras de mármore vieram da Itália e, sem que se soubesse,
Trouxeram em seu interior dois fósseis da pré-história italiana, que todo esse tempo ficaram preservados no saguão do Municipal. A descoberta dos fósseis não ajudou a restauração, mas por meio de seu estudo pode-se determinar a idade do mármore, isto é, quando ele foi formado. (Ciência ilustrada – número 17 – página 19)
LÍQUIDO
Na próxima vez que beber um refrigerante, olhe dentro do seu copo. O líquido toma a forma do vidro. Se você derramá-lo, a forma do líquido muda. Em um recipiente diferente, muda outra vez. O volume, entretanto, permanece o mesmo.

Observações macroscópica e microscópica de um copo contendo um líquido.
SAIBA MAIS
Água que entra e sai
Para nos mantermos saudáveis, devemos ingerir aproximadamente a mesma quantidade de água que perdemos.
Diariamente devemos ingerir cerca de 2 litros de água: 1 litro por meio de alimentos e 1 litro de líquidos.
A água está presente em todos os nossos órgãos e elementos que compõem nosso corpo. Os nossos músculos, por exemplo, contêm 75,6% de água; nossos rins contêm 82,7%; o cérebro, 74,5%; o sangue 83%; e até mesmo nossos ossos contêm água: 22%.
Como podemos ver, nossos órgãos são quase totalmente formados por água.
Diariamente, perdemos aproximadamente 2 litros de água: 1 litro através da urina; 0,5 litro através da respiração e 0,5 litro através da transpiração. Durante exercícios mais pesados, podemos perder quantidades ainda maiores de água. Quando a quantidade de água diminui em nosso corpo, sentimos sede.
A perda de 2% da água de nosso organismo é suficiente para nos provocar mal-estar. Se a perda for de 5%, nossa pele enruga e ficamos com a boca insuportavelmente seca. Com uma redução entre 12% e 15% da água de nosso corpo, morremos.
Na verdade, ao tomarmos água, estamos repondo não só a água que perdemos mas também os sais minerais necessários ao equilíbrio de nosso organismo.
Todas as reações químicas de nosso corpo necessitam de água. O sódio, o potássio, o cálcio, o fósforo e muitos outros sais minerais encontram-se dissolvidos nela e a reposição desses elementos, na quantidade adequada, é importante para manter cada um dos nossos órgãos em perfeito funcionamento.
GÁS
Um gás preenche rapidamente qualquer espaço onde for colocado porque suas partículas movem-se em alta velocidade. O gás não tem forma nem volume próprios e adquire a forma e volume de seu recipiente, como este balão em forma de pássaro, cheio de gás hélio. Objetos podem passar facilmente através do gás pois suas partículas são bem separadas.

Observações macroscópica e microscópica de um balão contendo um gás.
Diferença entre gás e vapor
Costuma-se diferenciar o gás do vapor da seguinte maneira: se a substância estiver habitualmente no estado gasoso – como o oxigênio, hidrogênio, nitrogênio, gás carbônico, etc.-, é considerado gás. Não estando habitualmente no estado gasoso – como os vapores de água, mercúrio e de iodo -, ao passar para este estado a substância é considerada vapor.
PROPRIEDADES QUÍMICAS
PROPRIEDADES QUÍMICAS
Caracterizam quimicamente os materiais através de reações químicas. Por exemplo:
COMBUSTÃO
Quando a matéria queima (combustível), significa que ela está reagindo com o oxigênio do ar. Essa propriedade se chama combustão. Para que ocorra combustão, é fundamental a presença do oxigênio (comburente).
Um exemplo disso é a queima da vela: se você colocar um copo virado sobre a vela acesa, a chama vai consumir o oxigênio contido no interior do copo e, nesse instante, a vela se apaga.

Assim que acendemos uma vela, observamos a formação de um líquido em seu topo, logo abaixo da chama. De onde veio este líquido? Veio da massa branca, a parafina de que é feito a vela, e que se derreteu sob a ação do calor da chama. O calor da chama também provoca a evaporação desse líquido.
Isto pode ser provado: colocando várias vezes uma faca na horizontal sobre o pavio, notamos que se forma na faca uma película branca e gordurosa, constituída de parafina que voltou a se liquefazer ao entrar em contato com a lâmina mais fria da faca. Esfriando-se um pouco mais, a parafina líquida torna-se sólida.
A chama é portanto produzida pela queima do vapor de parafina proveniente da vela. A parafina líquida sobe pelo pavio, o que torna mais fácil seu contato com o oxigênio, facilitando a combustão.
São as propriedades capazes de impressionar os nossos sentidos, como a cor, que impressiona a visão, o sabor e o odor, que impressionam o paladar e o olfato, respectivamente, e o estado de agregação da matéria (sólido, líquido, pó, pastoso), que impressionam o tato.
Este site foi atualizado em 05/05/09 |
PROPRIEDADES ESPECÍFICAS
Além das propriedades gerais que acabamos de estudar, a matéria apresenta outras propriedades, como cor, brilho e sabor. O sal, por exemplo, apresenta sabor, já a água destilada não. Portanto, as propriedades que são características de cada substância se denominam propriedades específicas da matéria.
São classificadas em: físicas, químicas e organolépticas.
PROPRIEDADES FÍSICAS
São propriedades que caracterizam fisicamente a matéria. As propriedades físicas importantes são: os pontos de fusão, solidificação, ebulição e liquefação da matéria; a condutividade; o magnetismo; a solubilidade; a dureza; a maleabilidade; a ductibilidade; a densidade; o calor específico.
PONTOS DE FUSÃO E SOLIDIFICAÇÃO
São as temperaturas nas quais a matéria passa da fase sólida para a fase líquida e da fase líquida para a fase sólida respectivamente, sempre em relação a uma determinada pressão atmosférica.

fusão: o ferro transformando-se em líquido

Solidificação: a água transformando-se em sólido
PONTOS DE EBULIÇÃO E CONDENSAÇÃO
São as temperaturas nas quais a matéria passa da fase líquida para a fase gasosa e da fase gasosa para a líquida respectivamente, sempre em relação a uma determinada pressão atmosférica.

ebulição: quando a água começa a ferver.

Condensação ou liquefação: as gotículas de água no vidro embaçado.
CONDUTIVIDADE
Certas matérias conduzem bem o calor e a eletricidade, como é o caso dos metais. O mesmo não acontece com outras substâncias, como o iodo, a água e o fósforo, que se apresentam resistentes na condução do calor e da eletricidade.



Usos do cobre: o cobre é um bom condutor de calor e eletricidade. Por isso, é utilizado para fazer utensílios de cozinha e para canos de água quente em residências e indústrias. Também serve para diferentes equipamentos elétricos, como fios condutores de eletricidade e bobinas de motores. O cobre não oxida facilmente por isso possui alta duração.
MAGNETISMO
Quando uma determinada matéria tem a propriedade de atrair o ferro, significa que ela apresenta propriedade magnética. Um exemplo de substância magnética natural é a magnetita (pedra imã natural), um minério de ferro.

Imã atraindo prego e limalha de ferro.
DUREZA
É a resistência que uma espécie de matéria apresenta ao ser riscada por outra.
Quanto maior a resistência ao risco, mais dura é a matéria.
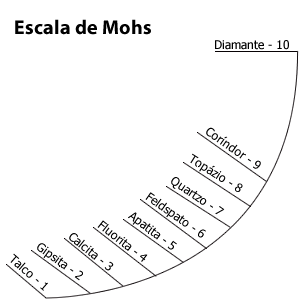
Escala de dureza de Mohs
Friedrich Mohs, um mineralogista alemão, criou uma tabela de dez minerais, com dureza relativa. Quanto mais alto o número, mais duro o mineral. Os minerais de valores numéricos altos (6, 7, 8) riscam os de valores relativos mais baixos (1, 2, 3, 4)
| Dureza | Mineral | Fórmula química |
|---|---|---|
| 1 | Talco, (pode ser arranhado facilmente com a unha) | Mg3Si4O10(OH)2 |
| 2 | Gipsita (ou Gesso), (pode ser arranhado com unha com um pouco mais de dificuldade) | CaSO4·2H2O |
| 3 | Calcita, (pode ser arranhado com uma moeda de cobre) | CaCO3 |
| 4 | Fluorita, (pode ser arranhada com uma faca de cozinha) | CaF2 |
| 5 | Apatita, (pode ser arranhada dificilmente com uma faca de cozinha) | Ca5(PO4)3(OH-,Cl-,F-) |
| 6 | Feldspato / Ortoclásio, (pode ser arranhado com uma liga de aço) | KAlSi3O8 |
| 7 | Quartzo, (capaz de arranhar o vidro. Ex.: Ametista) | SiO2 |
| 8 | Topázio, (Capaz de arranhar o quartzo) | Al2SiO4(OH-,F-)2 |
| 9 | Corindon, (Capaz de arranhar o Topázio) | Al2O3 |
| 10 | Diamante, (Mineral mais duro que existe, pode arranhar qualquer outro e é arranhado apenas por outro diamante ) | C |
O diamante é a matéria mais dura que se conhece, é utilizado em brocas que cortam o mármore e em estiletes de cortar vidro.
Existem vários tipos de diamantes, uns mais valiosos que outros. Só os mais caros são empregados na fabricação de jóias. Depois de lapidado, o diamante recebe o nome de brilhante.
O maior diamante já encontrado no mundo foi o Cullinan, procedente da África do Sul. Sua massa era de 3106 quilates (cerca de 620 gramas). O maior diamante encontrado no Brasil foi de 726 quilates (aproximadamente 150 gramas). O peso de um diamante é expresso em quilates. Um quilate, que é dividido em 100 pontos, equivale a 200 mg.
Obs.: você não deve confundir dureza (resistência ao risco) com a tenacidade (resistência ao impacto). Por exemplo: se você der uma martelada sobre um diamante, ele se despedaçará. Mas, se a martelada for sobre um pedaço de ferro, o máximo que poderá acontecer é ficar a marca do martelo sobre o ferro. Agora, se você passar o diamante sobre uma chapa de ferro, ficará um risco.
Conclusão
O diamante é mais duro que o ferro.
O ferro é mais tenaz que o diamante.
MALEABILIDADE
A matéria que pode ser facilmente transformada em lâminas é considerada maleável. Exemplos: ferro, alumínio, prata, ouro e chumbo.


Artesanato em ferro e madeira
DUCTIBILIDADE
É a propriedade que permite a matéria ser transformada em fio. É o que acontece com os metais: os fios de cobre, por exemplo, são usados para conduzir a eletricidade que chega em nossa casa.

Por ser um bom condutor de eletricidade, o cobre é usado como fio que conecta os aparelhos as tomadas
BRILHO
 É a capacidade que a matéria possui em refletir a luz que incide sobre ela. Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que ela não tem brilho. Uma matéria que não possui brilho, não é necessariamente opaca e vice-versa. Matéria opaca é aquela que não deixa atravessar a luz. Assim, uma barra de ouro é brilhante e opaca, pois reflete a luz sem se deixar atravessar por ela.
É a capacidade que a matéria possui em refletir a luz que incide sobre ela. Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que ela não tem brilho. Uma matéria que não possui brilho, não é necessariamente opaca e vice-versa. Matéria opaca é aquela que não deixa atravessar a luz. Assim, uma barra de ouro é brilhante e opaca, pois reflete a luz sem se deixar atravessar por ela.
CALOR ESPECÍFICO
É a quantidade de calor necessária para aumentar em 1 grau Celsius (1oC) a temperatura de 1 grama de massa de qualquer matéria. Por exemplo, o que demoraria mais para ferver, 1 litro de água (que tem 1000 g de massa) ou 2 litros de água (que tem 2000 g de massa)? Logicamente, 1 litro de qualquer substância ferve antes que dois litros, pois seu volume é menor. Mas, em ambos os casos, o calor específico é o mesmo, ou seja, 1 cal/g 0C.
Veja alguns valores que indicam o calor específico medidos à 15oC:
Água: 1,000 cal/goC); álcool etílico: 0,540 cal/goC; alumínio: 0,215 cal/goC; ferro: 0,110 cal/goC; zinco: 0,093 cal/goC.
Construindo um calorímetro

Calorímetro
O calorímetro é um instrumento utilizado para medir a quantidade de calor, fazer análises das trocas de calor que acontecem entre dois corpos localizados em seu interior, e ainda determinar o calor específico de um determinado elemento, que pode ser, por exemplo, o cobre. Esse equipamento é muito utilizado nos laboratórios de ensino quando se deseja realizar as análises citadas anteriormente. Ele pode ser comprado, como também confeccionado. Com materiais simples e do cotidiano dos alunos o professor de física pode instruir os alunos na confecção desse instrumento, a fim de fazer análises das quantidades de calor trocadas neste sistema isolado termicamente, ou seja, livre de trocas de calor com o meio ambiente.
Para construir um calorímetro, proceda da seguinte forma: pegue um recipiente de isopor que possua tampa bem ajustada, ou seja, que não possua folgas entre a tampa e as paredes do recipiente. Dentro deste último coloque outro recipiente de metal e com um algodão preencha os espaços existentes entre os dois recipientes. Na tampa da embalagem de isopor faça dois pequenos furos, um para o termômetro e outro para o agitador (uma pequena haste metálica, por exemplo). Está pronto o calorímetro.
Para medir a quantidade de calor e descobrir o calor especifico de um determinado material como o ferro, por exemplo, coloque uma determinada massa de água a temperatura de 20 °C dentro do calorímetro. Feito isso, pegue um pequeno pedaço de ferro, meça sua massa e depois aqueça-o até que ele atinja uma temperatura de 60°C. Ainda quente coloque-o dentro do calorímetro contendo água, feche bem e com o agitador agite o sistema para que ele entre em equilíbrio térmico. Sabendo a massa, a temperatura inicial e final da água e do ferro e utilizando a equação fundamental e o princípio da calorimetria, podemos fazer as análises das trocas de calor e descobrir qual é o calor específico do material.
DENSIDADE

Por que os icebergs conseguem boiar na água do mar?
Também chamada de densidade absoluta ou massa específica (d) de um corpo definido como a relação entre a massa do material e o volume por ele ocupado.
Essa definição é expressa da seguinte forma:

onde: m = massa do corpo (kg ou g)
V = volume ocupado pelo corpo (cm3 ou mL e L ou dm3)
D = densidade (kg/L ou g/L ou g/cm3)
Para sólidos e líquidos, a densidade é normalmente expressa em g/cm3, para gases, costuma-se expressar a densidade em g/L.
Quando dizemos que o metal ouro apresenta densidade de 19,3 g/cm3 à 20oC, isso significa que o volume de 1cm3 de ouro possui massa de 19,3 g.
A densidade varia com a temperatura, pois os corpos geralmente dilatam-se (aumentam de volume) com o aumento da temperatura. Quando não se menciona a temperatura, fica subentendido que ela é de 20oC.
SAIBA MAIS
A ESTRELA DE NÊUTRON
 O metal ósmio é o material mais denso da Terra (d = 22,6 g/cm3): 2 vezes mais denso que o chumbo (d = 11,4 g/cm3) e 22 vezes mais denso que a água (d = 1 g/cm3 à 4oC)
O metal ósmio é o material mais denso da Terra (d = 22,6 g/cm3): 2 vezes mais denso que o chumbo (d = 11,4 g/cm3) e 22 vezes mais denso que a água (d = 1 g/cm3 à 4oC)
Um dos mais densos materiais do Universo é o que constitui uma estrela de nêutron. A cabeça de um alfinete feito de uma estrela de nêutron pesaria um milhão de toneladas.
POR QUE OS CUBOS DE GELO BÓIAM?
Os cubos de gelo que colocamos num copo com água ou com bebida ficam boiando porque a densidade do gelo é menor que a da água. Ou seja, um certo volume de gelo possui massa menor que igual volume de água. Esse fenômeno explica também os icebergs, imensos blocos de gelo que flutuam na água do mar.

Em regiões polares, a presença de grandes blocos de gelo – icebergs - (água pura) é normal, flutuando na água do mar, que possui água e sais dissolvidos. Isto ocorre pois o gelo (d = 0,92 g/cm3) é menos denso que a água do mar (d = 1,03 g/cm3).
BOIAR NO MAR MORTO É MAIS FÁCIL
Por serem demasiadamente salgadas, as águas do mar Morto são mais densas que as de outros mares e oceanos. Sua densidade é de 1,119 g/cm3. Por isso, é praticamente impossível uma pessoa afogar-se nesse mar, pois seu corpo, quando mergulhado na água, recebe um grande empuxo (o corpo mergulhado na água é empurrado para cima com uma força igual ao peso do volume de água que desloca), que o mantém facilmente na superfície.

O mar Morto é assim tão salgado porque há 10.000 anos a capacidade de água que recebe dos rios e das chuvas é muito menor do que a que se evapora. Para se ter uma idéia da escassez de chuvas nessa região, basta comparar o índice de precipitação pluviométrica em São Paulo e na região do mar Morto. Enquanto em São Paulo, muitas vezes, em um dia chove cerca de 100 mm, naquela região a quantidade de chuva fica em torno de 45 mm por ano.
APLICAÇÃO DA DENSIDADE
® DETERMINAÇÃO DA QUALIDADE DO LEITE
 O leite é constituído de vários materiais dissolvidos na água, apresentando um valor de densidade característico. A adição de outros materiais ou de água, altera sua densidade, permitindo verificar por meio do densímetro apropriado, se houve alguma alteração do produto (uréia dissolvida em água apresenta um valor de densidade muito próximo ao leite, por isso alguns fazendeiros inescrupulosos, para aumentar o seu lucro, adicionam uréia ao leite, quando não utilizam um produto mais barato: a própria urina da vaca).
O leite é constituído de vários materiais dissolvidos na água, apresentando um valor de densidade característico. A adição de outros materiais ou de água, altera sua densidade, permitindo verificar por meio do densímetro apropriado, se houve alguma alteração do produto (uréia dissolvida em água apresenta um valor de densidade muito próximo ao leite, por isso alguns fazendeiros inescrupulosos, para aumentar o seu lucro, adicionam uréia ao leite, quando não utilizam um produto mais barato: a própria urina da vaca).
® VERIFICAÇÃO DA CARGA DA BATERIA
As baterias dos automóveis possuem ácido sulfúrico em quantidade apropriada, logo com um valor definido de densidade. A medida do valor dessa densidade (feita com densímetro apropriado) indica se a bateria está descarregada ou não.

® VERIFICAÇÃO DA QUALIDADE DO ÁLCOOL COMBUSTÍVEL

Com o densímetro, pode-se conferir a qualidade do álcool pela determinação de sua densidade.
O álcool combustível vendido nos postos de abastecimento contém uma certa quantidade de água (álcool hidratado). Essa mistura é padronizada e apresenta um valor definido de densidade. Ao lado das bombas de álcool existe um recipiente transparente contendo a mistura água/álcool e duas bolinhas de densidades diferentes (uma com densidade um pouco maior que a mistura – que fica no fundo do recipiente – e outra com uma densidade um pouco menor que a mistura – que fica na parte superior do recipiente). Quando a proporção água/álcool é alterada, modifica-se a densidade da mistura, fazendo com que as bolinhas fiquem no mesmo lado (as duas na parte superior ou na parte inferior).

Assinar:
Postagens (Atom)










