QUÍMICA - Matéria
Matéria: tudo o que possui massa e ocupa lugar no espaço.
Corpo: toda porção limitada de matéria.
Extensão: espaço ocupado pela matéria. Sua medida é o volume.
Substância: espécie de matéria que se distingue por suas qualidades.
2. Os estados físicos da matéria
Características dos estados:
• sólido: forma e volume constantes (partículas bem próximas umas das outras).
• líquido: volume constante e forma variável (partículas mais afastadas umas das outras).
•gasoso: forma e volume variáveis (as partículas ficam bem afastadas umas das outras).
Mudanças de estado físico:
a) Fatores determinantes: pressão e temperatura
b) Processos:
• Fusão: passagem de sólido para líquido, com aumento de temperatura ou diminuição de pressão. Ocorre a uma determinada temperatura (ponto de fusão), que permanece constante durante o processo. Com o aumento da pressão, o ponto de fusão fica mais alto.
• Solidificação: passagem de líquido para sólido, com aumento de pressão ou diminuição de temperatura. Ocorre a uma determinada temperatura (ponto de solidificação), que permanece constante.
• Vaporização: passagem de líquido para gasoso, com aumento de temperatura ou diminuição de pressão.
Tipos:
— evaporação (processo lento na temperatura ambiente);
— ebulição (processo rápido, com formação de bolhas gasosas na massa líquida);
— calefação (líquido em presença de superfície superaquecida).
•Condensação (ou liquefação): passagem de gasoso para líquido, com aumento de pressão ou diminuição de temperatura. Ocorre a uma determinada temperatura (ponto de condensação), que permanece constante.
• Sublimação: passagem de sólido diretamente para gasoso e vice-versa. Lembre que:
• Ponto de ebulição é a temperatura em que ocorre a ebulição (ela é constante durante o processo). O ponto de ebulição aumenta com o aumento da pressão.
A evaporação da água é tanto mais rápida quanto maior a superfície, maior a ação dos ventos e menor a umidade relativa do ar.
• A substância que nas condições naturais mantém-se no estado gasoso é chamada gás; chama-se vapor quando nas condições naturais é líquida ou sólida, mas em condições especiais pode passar para o estado gasoso.
• O ponto de ebulição da água, nas condições normais de pressão (ao nível do mar), é 100 Cº.
• O ponto de fusão do gelo, nas condições normais de pressão, é O °C. 1A matéria
Fenômeno: qualquer transformação que ocorre na natureza. Para estudá-lo, experimenta-se, faz-se observações, interpretam-se os resultados e tiram-se conclusões.
Físico: não altera a estrutura da matéria.
Químico: altera a estrutura da matéria.
Propriedades da matéria
Gerais: referem-se a toda e qualquer espécie de matéria.
Específicas: caracterizam cada substância,
1. Propriedades gerais:
a) Extensão: a matéria ocupa lugar no espaço. Sua medida é o volume, e suas unidades de medidas são o metro cúbico (m3), o centímetro cúbico (cm3), etc.
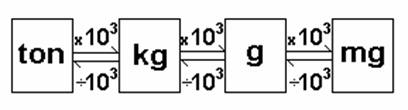
b) Massa: quantidade de matéria contida nos corpos. Pode ser medida em balanças. Suas unidades de medida são o quilograma (kg), o grama (g), etc.
c) Inércia: propriedade pela qual a matéria só modifica seu estado de repouso ou de movimento quando sob a ação de forças. Sua medida é a massa.
d) Impenetrabilidade: duas porções de matéria não podem ocupar, ao mesmo tempo, ao mesmo lugar no espaço.
e) Divisibilidade: a matéria pode ser subdividida até certo limite, conservando as propriedades das substâncias.
f) Indestrutibilidade: a matéria não é criada nem destruída, mas pode ser transformada.
g) Compressibilidade: a matéria pode ser reduzida em seu volume por ação de pressão.
h) Elasticidade: a matéria comprimida volta às condições primitivas quando cessa a pressão atuante sobre ela.
2. Propriedades específicas:
Físicas:
a) Calor específico: quantidade de calor necessária para elevar de 1°C a temperatura de 1 g da substância.
b) Densidade: relação entre massa e volume de uma substância: d=m/v
c) Solubilidade: propriedade pela qual uma substância (soluto) se dissolve na massa de outra (solvente).
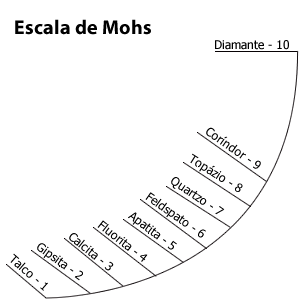
d) Dureza: resistência que as substâncias oferecem ao risco.
e) Maleabilidade: capacidade de uma substância ser transformada em lâmina (chumbo, ouro).
f) Ductibilidade: propriedade de uma substância ser transformada em fios.
• Químicas: transformações que as substâncias sofrem na sua estrutura durante as combustões, oxidações, etc.
•Organolépticas: aquelas que impressionam nossos órgãos dos sentidos, como a cor, o odor, o sabor, etc.
ATIVIDADES
1-Defina e exemplifique:
a) matéria
b)corpo
c)fenômeno
d)fenômeno físico
e)fenômeno químico
f)substâncias
g)objeto
a) matéria
b)corpo
c)fenômeno
d)fenômeno físico
e)fenômeno químico
f)substâncias
g)objeto
2-O atrito de dois corpos produzindo calor é fenômeno físico ou químico? Por quê?
3-A produção do vinho a partir do suco de uva é um fenômeno físico ou químico? Por quê?
4-Como se denomina o espaço ocupado pela matéria? E sua medida?
5-complete o quadro:
Estados físicos Forma Volume
Sólido
Liquido
Gasoso
6- Qual o fator determinante dos três estados físicos da matéria?
7- A matéria pode mudar de um estado físico para outro. Quais os fatores responsáveis por isso?
8- Por que em planalto a água ferve a uma temperatura mais baixa do que a beira-mar?
9-Qual a diferença entre gás e vapor?
10- Esquematize as mudanças de estados físicos da matéria:
3-A produção do vinho a partir do suco de uva é um fenômeno físico ou químico? Por quê?
4-Como se denomina o espaço ocupado pela matéria? E sua medida?
5-complete o quadro:
Estados físicos Forma Volume
Sólido
Liquido
Gasoso
6- Qual o fator determinante dos três estados físicos da matéria?
7- A matéria pode mudar de um estado físico para outro. Quais os fatores responsáveis por isso?
8- Por que em planalto a água ferve a uma temperatura mais baixa do que a beira-mar?
9-Qual a diferença entre gás e vapor?
10- Esquematize as mudanças de estados físicos da matéria:
11-Relacione as colunas:
(a)compressibilidade ( )a matéria ocupa lugar nos espaço.
(b)massa ( )duas porções de matéria não podem, ao mesmo tempo,
(c)impenetrabilidade ( )ocupar o mesmo lugar no espaço. .
(d)inércia ( )quantidade de matéria de um corpo.
(e) extensão ( )a matéria só modifica seu estado de repouso ou de
( )Movimento quando sob ação de forças.
( )sob a ação de forças a matéria reduz o volume.
(a)compressibilidade ( )a matéria ocupa lugar nos espaço.
(b)massa ( )duas porções de matéria não podem, ao mesmo tempo,
(c)impenetrabilidade ( )ocupar o mesmo lugar no espaço. .
(d)inércia ( )quantidade de matéria de um corpo.
(e) extensão ( )a matéria só modifica seu estado de repouso ou de
( )Movimento quando sob ação de forças.
( )sob a ação de forças a matéria reduz o volume.
12- O que são propriedades especifica da matéria? Como podem ser?
13- Um fragmento de gelo de 250 g tem volume correspondente a 500 cm3. qual é sua densidade?
14- A densidade de um fragmento de chumbo é 11,4 g/cm3. sabendo-se que esse fragmento de metal ocupa um volume de 57 cm3, qual é sua massa?
13- Um fragmento de gelo de 250 g tem volume correspondente a 500 cm3. qual é sua densidade?
14- A densidade de um fragmento de chumbo é 11,4 g/cm3. sabendo-se que esse fragmento de metal ocupa um volume de 57 cm3, qual é sua massa?
15-Um corpo de massa igual a 200 g e tem um volume de 400 cm3. Responda:
a)Qual a densidade desse corpo? ___________________
b)Colocando num recipiente com água esse corpo afunda ou flutua? ___________________
16-Indique nas reações abaixo as transformações físicas e químicas:
a)queima do gasolina nos motores dos carros ___________________
b)digestão dos alimentos ingeridos ________________
c)acender uma lâmpada ___________________
d)formação da ferrugem ___________________
e)quebra de um objeto ___________________
f)enfiar um prego na madeira ___________________
g)derretimento de um iceberg ___________________
h)crescimento de uma planta ___________________
16-Indique nas reações abaixo as transformações físicas e químicas:
a)queima do gasolina nos motores dos carros ___________________
b)digestão dos alimentos ingeridos ________________
c)acender uma lâmpada ___________________
d)formação da ferrugem ___________________
e)quebra de um objeto ___________________
f)enfiar um prego na madeira ___________________
g)derretimento de um iceberg ___________________
h)crescimento de uma planta ___________________

















 É a capacidade que a matéria possui em refletir a luz que incide sobre ela. Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que ela não tem brilho. Uma matéria que não possui brilho, não é necessariamente opaca e vice-versa. Matéria opaca é aquela que não deixa atravessar a luz. Assim, uma barra de ouro é brilhante e opaca, pois reflete a luz sem se deixar atravessar por ela.
É a capacidade que a matéria possui em refletir a luz que incide sobre ela. Quando a matéria não reflete a luz, ou reflete muito pouco, dizemos que ela não tem brilho. Uma matéria que não possui brilho, não é necessariamente opaca e vice-versa. Matéria opaca é aquela que não deixa atravessar a luz. Assim, uma barra de ouro é brilhante e opaca, pois reflete a luz sem se deixar atravessar por ela.


 O metal ósmio é o material mais denso da Terra (d = 22,6 g/cm3): 2 vezes mais denso que o chumbo (d = 11,4 g/cm3) e 22 vezes mais denso que a água (d = 1 g/cm3 à 4oC)
O metal ósmio é o material mais denso da Terra (d = 22,6 g/cm3): 2 vezes mais denso que o chumbo (d = 11,4 g/cm3) e 22 vezes mais denso que a água (d = 1 g/cm3 à 4oC)

 O leite é constituído de vários materiais dissolvidos na água, apresentando um valor de densidade característico. A adição de outros materiais ou de água, altera sua densidade, permitindo verificar por meio do densímetro apropriado, se houve alguma alteração do produto (uréia dissolvida em água apresenta um valor de densidade muito próximo ao leite, por isso alguns fazendeiros inescrupulosos, para aumentar o seu lucro, adicionam uréia ao leite, quando não utilizam um produto mais barato: a própria urina da vaca).
O leite é constituído de vários materiais dissolvidos na água, apresentando um valor de densidade característico. A adição de outros materiais ou de água, altera sua densidade, permitindo verificar por meio do densímetro apropriado, se houve alguma alteração do produto (uréia dissolvida em água apresenta um valor de densidade muito próximo ao leite, por isso alguns fazendeiros inescrupulosos, para aumentar o seu lucro, adicionam uréia ao leite, quando não utilizam um produto mais barato: a própria urina da vaca).



.jpg)













 Desde a antiguidade, jarros e vasilhas foram utilizados como unidades de medida para comercializar líquidos como o vinho, o leite, etc. É o caso da ânfora dos romanos, equivalente a aproximadamente 25,44 litros. Curiosamente, até o século XIX era comum, no interior do Brasil, a compra e venda de arroz, feijão, milho, etc. em litros, já que as balanças eram raras e custavam caro. Atualmente, a unidade oficial, estabelecido pelo Sistema Internacional (SI), é o metro cúbico (m3). No entanto, a unidade mais usada é o litro (L) e também o centímetro cúbico (cm3). Além disso, também persistem unidades antigas, como por exemplo tintas são vendidas em galões.
Desde a antiguidade, jarros e vasilhas foram utilizados como unidades de medida para comercializar líquidos como o vinho, o leite, etc. É o caso da ânfora dos romanos, equivalente a aproximadamente 25,44 litros. Curiosamente, até o século XIX era comum, no interior do Brasil, a compra e venda de arroz, feijão, milho, etc. em litros, já que as balanças eram raras e custavam caro. Atualmente, a unidade oficial, estabelecido pelo Sistema Internacional (SI), é o metro cúbico (m3). No entanto, a unidade mais usada é o litro (L) e também o centímetro cúbico (cm3). Além disso, também persistem unidades antigas, como por exemplo tintas são vendidas em galões.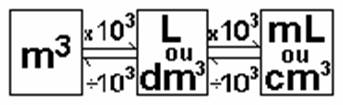
 Você já tentou colocar dois objetos no mesmo lugar? Ou um ficará ao lado do outro ou por cima ou na frente, mas nunca exatamente no mesmo lugar. Fazer com que ambos ocupem o mesmo espaço é totalmente impossível, pois duas porções de matéria não podem ocupar o mesmo lugar no espaço no mesmo tempo.
Você já tentou colocar dois objetos no mesmo lugar? Ou um ficará ao lado do outro ou por cima ou na frente, mas nunca exatamente no mesmo lugar. Fazer com que ambos ocupem o mesmo espaço é totalmente impossível, pois duas porções de matéria não podem ocupar o mesmo lugar no espaço no mesmo tempo. Com o auxílio de um martelo, podemos reduzir a pó um pedaço de giz, de grafite, de granito, de madeira, etc. Isso é possível porque a matéria pode ser dividida em pequenas partículas. Da mesma forma, com um gota de anilina podemos tingir a água contida num copo. Isso ocorre porque a anilina tem a propriedade de dividir-se em partículas muito pequenas, que se espalham pela água.
Com o auxílio de um martelo, podemos reduzir a pó um pedaço de giz, de grafite, de granito, de madeira, etc. Isso é possível porque a matéria pode ser dividida em pequenas partículas. Da mesma forma, com um gota de anilina podemos tingir a água contida num copo. Isso ocorre porque a anilina tem a propriedade de dividir-se em partículas muito pequenas, que se espalham pela água.

 Desta forma podemos definir elasticidade como uma propriedade em que a matéria, dentro de um certo limite, se submetida à ação de uma força causando deformação, ela retornará à forma original, assim que essa força deixar de agir. Isto ocorre porque seus espaços interatômicos e intermoleculares diminuem ou aumentam.
Desta forma podemos definir elasticidade como uma propriedade em que a matéria, dentro de um certo limite, se submetida à ação de uma força causando deformação, ela retornará à forma original, assim que essa força deixar de agir. Isto ocorre porque seus espaços interatômicos e intermoleculares diminuem ou aumentam.